治験実施前
- 1依頼(手続き説明)
- 2申請受付
- 3事前ヒアリング
- 4医薬品等受託研究審査委員会(IRB)
- 5承認
- 6スタートアップ・ミーティング
- 7契約締結
- 8治験薬受領
上記手続きがすべて終了後、治験スタート
依頼(手続き説明)
依頼者には治験の概略を説明していただきます。その後、各担当者より下記の事項を説明いたします。
| 臨床研究支援オフィス 事務 |
1.治験実施計画書の提出日を確認し、事前ヒアリングの日程を調整します。 2.当院の治験実施までの事務的な流れを説明します。 3.申請時の提出書類を説明します。 4.IRB委員名簿・SOP・様式について説明します。 |
|---|---|
| ライフサイエンス振興課 | 契約書や経費について確認します。 |
| CRC |
1.保険外併用療養費や負担軽減費などを確認します。 2.外注検査・特殊検査について説明します。 3.提供物品(貸与機器や資材)について確認します。 |
| 治験薬管理担当者 |
1.「治験薬の概略」と「治験の概要ならびに同種・同効薬品」の記載について説明します。 |
※責任医師の内諾および治験届後、治験実施計画書が確定してから、手続き説明・事前ヒアリングの日程調整をします。
治験の概要ならびに同種・同効薬品に関して
(治験依頼者⇔治験薬管理担当者)
「治験の概要ならびに同種・同効薬品」は、所定の様式に記載して提出してください。
同種・同効薬品、併用禁止薬品リストは、該当する全商品名(日本医薬品集等参考)、一般名、剤形・規格、薬効分類、その他の順番で作成してください。
事前ヒアリング
-
事前ヒアリングに関しては、
事務担当者より案内があります。

-
事前ヒアリング完了報告書(臨床研究支援オフィス作成)
メールで治験依頼者に送付します。

-
事前ヒアリング回答書(治験依頼者作成)
同意説明文書をメールで臨床研究支援オフィスに送付してください。

- IRB開催の2週間前までに、IRB用資料を提出してください。(郵送可)
【IRB用資料】
1.電子ファイル
●PDFでお願いします
- ・治験実施計画書
- ・治験薬概要書
- ・同意説明文書(最終版)
- ・同意説明文書(変更履歴付き版)
- ・治験の費用の負担について説明した文書
- ・被験者の健康被害の補償について説明した文書
- ・被験者の安全等に係る資料
- ・治験参加カード
- ・回答書(日付は固定日)
2.紙媒体
●上記1.の電子ファイルと同様の紙媒体で作成したファイル 2部
※治験依頼書1部、治験分担医師協力者リスト1部、治験責任医師履歴書1部、回答書原本1部、治験受入審査申請書1部(全て押印なくても可)
スタートアップミーティング
契約後、治験担当スタッフの役割を確認し、治験を円滑に進める目的でスタートアップミーティングを行います。詳細に関しては初回説明時の資料をご確認ください。
- 出席者:治験依頼者、治験責任医師、治験コーディネーター、治験薬管理担当者、分担医師(可能な範囲で)
- 内 容:治験概要のご説明の後、治験の進め方、役割分担、処方の仕方、治験会計の仕方(保険外併用療養費、負担軽減費、依頼者負担薬剤の確認)等を話し合います。
-
ご不明点やご確認がありましたら、担当CRCにご連絡ください。
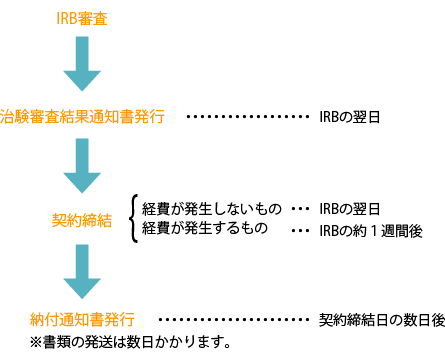
IRB審査から契約までの流れ